低酸素環境でのクロロフィル生合成
シアノバクテリアは、植物と同じ酸素(O2)を発生する光合成(酸素発生型光合成oxygenic photosynthesis)によって生育します。水分子を電子供与体とすることで、シアノバクテリアは、光と水が利用可能であれば基本的にどんな場所で生育することができます。海洋、湖沼、河川、微生物マット、水田などの水域のみならず地表面など陸上また、温泉などの高温環境でも生息しています。これらシアノバクテリアの生育環境をO2レベルという観点で見るとたいへん多様です。例えば、湖沼の底や河川の泥などは普段でもO2レベルがたいへん低い環境です。また、微生物マットではシアノバクテリアは比較的表層付近に生息し、昼間は自身の光合成によって高いO2レベルの環境(時には過飽和に達する)となりますが、夜間は周囲の従属栄養性微生物の活発な呼吸(当然シアノバクテリア自身の呼吸も寄与します)によりO2レベルはほぼゼロの嫌気的環境となります。また、日暮れや夜明け、雲が多い日中などの光合成活性が低いときには低酸素(微好気)環境におかれます。
1)クロロフィル生合成系における好気型酵素と低酸素型酵素の併存
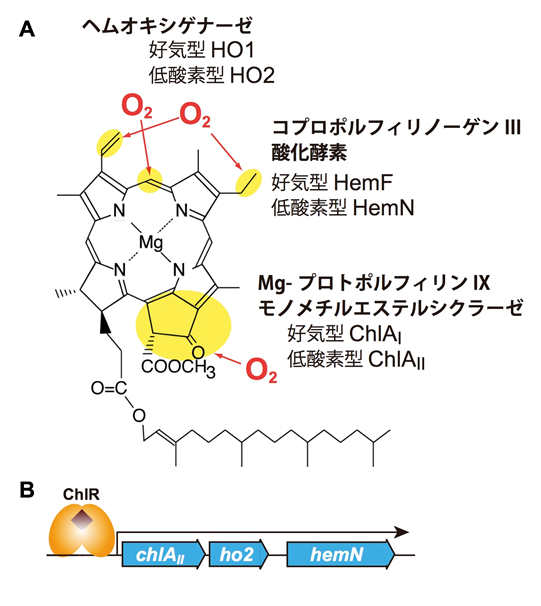
A. クロロフィルaの構造において、黄色い部分はO2が必要とされる反応によって作られる3つの構造部分と関与する酵素を示します。B. これらの反応を低酸素でバイパスする3つの酵素をコードする遺伝子は、chlAII-ho2-hemNという一つの遺伝子クラスターを形成しています。転写制御タンパク質ChlRは、低酸素を感知して、これらの遺伝子の発現を誘導します。
テトラピロール色素は、生物にとってたいへん重要な化合物です。光合成にはクロロフィルが、呼吸にはヘムが必須です。また、生体の多くの反応がビタミンB12を補酵素とする酵素によって触媒されます。シアノバクテリアの光合成をささえるクロロフィルの生合成系を見ると、反応にO2を要求する酵素が少なくとも2段階存在することが分かります(図2.1A)。一つはコプロポルフィリノーゲンIII酸化酵素(CPO)、もう一つはクロロフィルの5番目の環構造を形成するMg-プロトポルフィリンIXモノメチルエステル(MPE)シクラーゼです(クロロフィルaの13位のオキソ基のO原子はO2分子に由来します)。また、光合成補助色素であるフィコビリンは、ヘムをO2依存的に開裂するヘムオキシゲナーゼ(HO)によって作られています(図2.1A)。これらのO2依存性の反応が含まれるクロロフィルやヘムの生合成系は、嫌気環境や低酸素環境ではどのように作動しているのでしょう?
シアノバクテリアSynechocystis sp. PCC 6803を材料とした私たちの研究により、低酸素環境でのシアノバクテリアのクロロフィル生合成系は、酸素依存型反応が“低酸素型”酵素によってバイパスされることで支えられていることがわかりました。
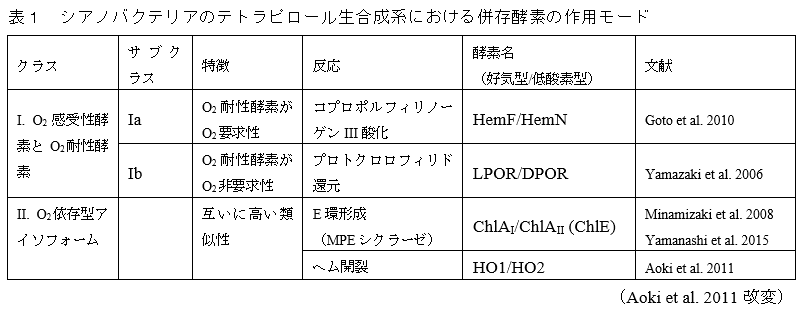
シアノバクテリアのクロロフィル・ヘム・フィコビリン色素の生合成系における3つのO2依存型反応には、“低酸素型”酵素が併存しています。CPO反応には、O2依存的な反応を触媒するHemFという酵素に加えて、低酸素や嫌気的環境下ではO2を使わないで反応を触媒するHemNという酵素が作動します。MPEシクラーゼ反応では、好気的環境では通常型の酵素としてChlAIが使われますが、低酸素環境では低酸素型のアイソフォームChlAIIがChlAIの活性を補完します。同様に、HO反応でも、好気的環境では通常型酵素HO1が使われますが、低酸素環境では低酸素型アイソフォームHO2がHO1の活性を補完します。このように、低酸素型酵素の併存によりO2依存型反応をうまくバイパスしていることが分かってきました(図2.1A)。これらに加えて、O2はニトロゲナーゼ類似酵素DPORを不活性化するという作用をもつため、好気環境ではこの負の作用をバイパスするためにO2耐性の酵素LPORが使われることも、多様なO2レベルに対する適応機構の一つとなっています。これらをまとめると以下の表1のようになります。
2)低酸素型酵素の発現を誘導する転写制御タンパク質ChlR
上記の低酸素型酵素群はDPORを除いてすべて低酸素環境下で初めて誘導発現され、好気的環境下での発現レベルは極めて低く抑制されています。このような低酸素誘導機構はどのようなメカニズムによって成立しているのでしょうか。私たちは、この低酸素誘導を制御している新しい転写制御タンパク質ChlRを発見しました (図2.1B;Aoki et al. 2012)。ChlRは好気条件下では不活性型として存在していますが、低酸素環境に曝されると何らかの構造変化が引き起こされ特定のDNA配列(低酸素で誘導される遺伝子の上流配列)に結合し、RNAポリメラーゼによる転写を活性化します。このメカニズムにより、低酸素型酵素群の発現が転写レベルで制御されているのです。ChlRは低酸素を感知するセンサータンパク質としてもはたらくユニークな転写活性化タンパク質です。
3)chlR欠損株を利用した“酸素依存型”緑化
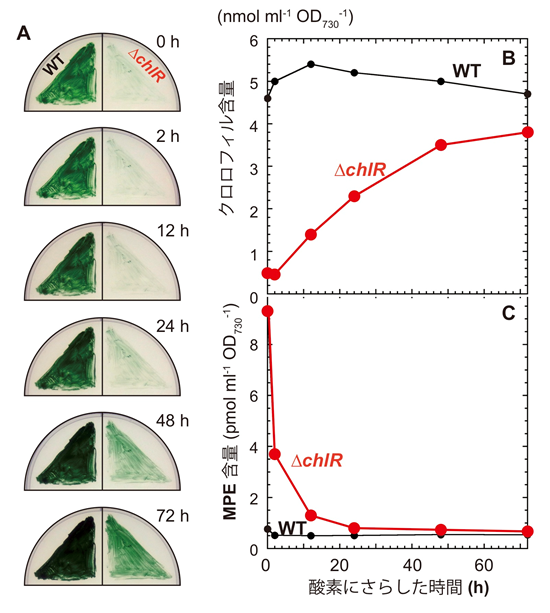
A. 嫌気条件では∆chlRはほとんど成長せず、細胞は青い色を呈します。この細胞を酸素にさらすと2 hのラグの後クロロフィルa含量の増加が始まります。B. C. 酸素依存的緑化に伴うクロロフィル (A) と蓄積中間体MPE (B) の含量変化。MPEは24 hでほとんど野生型のレベルまで低下しますが、クロロフィルの含量の回復には、72 h程度必要とされます。(Aoki et al. 2014改変)
chlR遺伝子が欠損した変異株∆chlRは、低酸素条件ではクロロフィルの生合成が滞り光合成的生育が著しく抑制され、クロロフィル不足を示す青い色を呈する細胞となります。しかし、この細胞を好気条件に移すと、徐々に緑化が進行し、3日後には野生型と同じ程度にクロロフィル含量が回復し緑色に戻ります(図2.2)。この“酸素依存型”緑化 (oxygen-induced greening) は、この変異株を利用することで初めて観測されためずらしい現象です (Aoki et al. 2014)。暗所で黄化した被子植物芽生えが明所で緑化する光依存型緑化とは異なる、光化学系構築機構を研究するための新たな系となることが期待されます。
文献
Goto, T., Aoki, R., Minamizaki, K. and Fujita, Y. (2010) Functional differentiation of two analogous coproporphyrinogen III oxidases for heme and chlorophyll biosynthesis pathways in the cyanobacterium Synechocystis sp. PCC 6803. Plant Cell Physiol. 51, 650-663.
Yamazaki, S., Nomata, J. and Fujita, Y. (2006) Differential operation of dual protochlorophyllide reductases for chlorophyll biosynthesis in response to environmental oxygen levels in the cyanobacterium Leptolyngbya boryana. Plant Physiol. 142, 911-922
Minamizaki, K., Mizoguchi, T., Goto, T., Tamiaki, H. and Fujita, Y. (2008) Identification of two homologous genes, chlAI and chlAII, that are differentially involved in isocyclic ring formation of chlorophyll a in the cyanobacterium Synechocystis sp. PCC 6803. J. Biol. Chem. 283, 2684-2692.
Yamanashi, K., Minamizaki, K. and Fujita, Y. (2015) Identification of the chlE gene encoding oxygen-independent Mg-protoporphyrin IX monomethyl ester cyclase in cyanobacteria. Biochem. Biophys. Res. Commun. 463, 1328-1333.
Aoki, R., Goto, T. and Fujita, Y. (2011) A heme oxygenase isoform is essential for aerobic growth in the cyanobacterium Synechocystis sp. PCC 6803: Modes of differential operation of two isoforms/enzymes to adapt low oxygen environments in cyanobacteria. Plant Cell Physiol. 52, 1744-1756.
Aoki, R., Takeda, T., Omata, T., Ihara, K. and Fujita, Y. (2012) MarR-type transcriptional regulator ChlR activates expression of tetrapyrrole biosynthesis genes in response to low-oxygen conditions in cyanobacteria. J. Biol. Chem. 287, 13500-13507.
Aoki, R., Hiraide, Y., Yamakawa, H. and Fujita, Y. (2014) A novel “oxygen-induced” greening process in a cyanobacterial mutant lacking the transcriptional activator ChlR involved in low-oxygen adaptation of tetrapyrrole biosynthesis. J. Biol. Chem. 289, 1841-1851.
青木里奈、藤田祐一 (2012) ラン藻のテトラピロール生合成系の嫌気環境適応と進化的視点 光合成研究 22, 87-97.
Fujita, Y., Tsujimoto, R. and Aoki, R. (2015) Evolutionary aspects and regulation of tetrapyrrole biosynthesis in cyanobacteria under aerobic and anaerobic environments. Life, 5, 1172-1203.