プロトクロロフィリド還元酵素の生理生化学
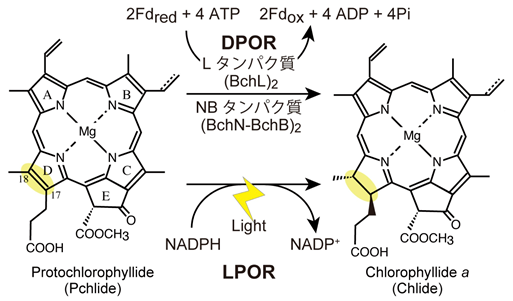
D環の二重結合(C17=C18)がPchlide還元酵素によって還元され、クロロフィリドaに変換されます。クロロフィリドaはクロロフィルaの直接の前駆体であり、クロロフィルaと同じ分光学的特性を示すことから、Pchlide還元は緑のクロロフィルを作る最終反応と見ることができます。
プロトクロロフィリド還元系(図1.1)は、クロロフィル生合成の最終段階の反応です。この反応によりクロロフィルは特有の緑色を呈するようになり、すなわち光合成が可能となる光吸収特性を獲得する重要な反応です。また、緑化の光依存性を決定づける反応でもあります。藤田は、プロトクロロフィリド還元反応を光に依存せずに触媒する酵素“暗所作動型プロトクロロフィリド還元酵素(Dark-operative または Light-independent Protochlorophyllide Oxidoreductase 略してDPOR)”の遺伝子を世界に先駆けて同定しました (Fujita et al. 1992)。(この発見の詳細はこちら)この発見を基盤として、プロトクロロフィリド還元酵素を中心に、クロロフィルの生合成系機構を、進化的視点をふまえて生化学的、生理学的研究を進めています。
1)暗所作動型(光非依存型)光非依存型プロトクロロフィリド還元酵素の生化学

嫌気チャンバーの内部は1%程度の水素を含む窒素ガスで充填されており、O2レベルは1 ppm以下に保たれています。DPORやニトロゲナーゼは、酸素に触れると秒単位で失活してしまうため、精製から活性測定までの一連の操作を嫌気チャンバーの中で行います。
藤田は、DPOR(図2)の酵素サブユニットを精製し、精製タンパク質による活性測定系を確立することに成功しました(Fujita and Bauer, 2000)。この実験系を活用し、DPORの生化学的解析や進化的に関連の深いニトロゲナーゼとの類似性について研究を進めています。なお、これらの酵素は酸素に触れるとすぐに失活してしまうため、実験操作はすべて嫌気チャンバー内(図1.2)で行っています。
DPORの生化学的特性を踏まえ、その反応機構を明らかにするために、DPORの触媒コンポーネント(NBタンパク質(図1.3a))の結晶構造解析を試みました。幸いなことに、その立体構造を世界に先駆けて解明することに成功し、構造に基づく反応機構を提唱することができました。この成果は、Nature(2010年5月6日号; Muraki et al. 2010)に掲載されました。
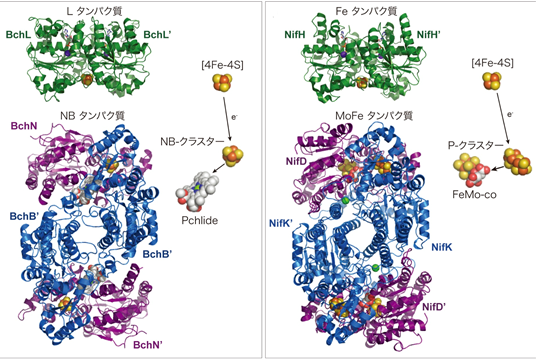
構造的に対応する蛋白質を同じ色で示します。また、各構造の右側に、電子伝達に関わる金属中心と基質の空間配置と電子伝達の方向を示します(藤田 2011)。
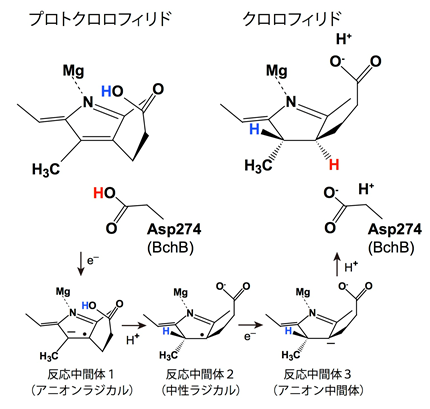
PchlideのC17=C18二重結合近傍をクローズアップしました。電子とプロトン(プロトン供与体はPchlide自身のプロピオン酸とBchBのAsp274)が順次Pchlideへ移動し、反応が進行します。その最初の過程で、一電子がPchlideに移動することによりPchlideラジカル中間体が生じます。
DPOR(図1a)もニトロゲナーゼ(図1b)ともに二つのコンポーネント;還元コンポーネント(L タンパク質、Fe タンパク質)と触媒コンポーネント(NB タンパク質、MoFe タンパク質)から構成され、これらは立体構造的にも互いに非常によく似ていることが分かりました。また、電子が移動する経路を、金属中心と基質とともに、結晶構造から抜き出して結晶構造の右側に示しています。ニトロゲナーゼでは、電子は、Fe タンパク質の[4Fe-4S]クラスターからP-クラスターを経由してFeMo-coと呼ばれるMoを含む複雑な金属中心に到達し、FeMo-co上に結合する窒素分子の還元に使われます。DPORにおいても、L-タンパク質の[4Fe-4S]クラスターからNB-クラスターを経由してプロトクロロフィリド(Pchlide)へと電子が移動します。これらの金属中心と基質の空間配置が、両酵素間でたいへんよく保存されていることがわかりました。このことは、安定な多重結合、窒素原子間の三重結合やポルフィリン環の共鳴二重結合、を還元する共通構造基盤が存在することを示しています(図1.3)。また、C17=C18二重結合の還元は立体特異的です(C17とC18へのプロトンは各々下方、上方にtrans特異的に付加されます; 図1.4)。この立体特異性は、各々へのプロトン供与体(C17に対しBchBのAsp274、C18に対して基質自身のプロピオン酸)の立体的な空間配置によって確保されていることが、Pchlide結合部位の構造から推定されます。なお、この研究は、栗栖源嗣教授(大阪大学)と民秋均教授(立命館大学)と共同で行われました。また、この成果を含めた総説が、植物関係のレビュー誌Trends in Plant Sciencesの2010年11月号の表紙を飾りました(Reinbothe et al. 2010)。

Pchlide還元では、C17=C18二重結合に2つの電子と2つのプロトンが導入されますが、これら電子(e–)とプロトン(H+)の移動はどのように協調されているのでしょうか。このことを、部位特異的変異タンパク質、基質アナログを用いて、吸収スペクトルと電子スピン共鳴スペクトルで解析しました。その結果、電子とプロトンは一個ずつ順次移動し、その最初の電子移動の過程でPchlideラジカル(Pchlideが電子を一つだけ取り込んだ状態)が生じることが示唆されました(図1.4.; Nomata et al. 2014)。この分子機構は、同じPchlide還元を光依存的に触媒するPchlide還元酵素(Light-dependent Protochlorophyllide Oxidoreductase; LPOR)とまったく異なります。LPORでは、NADPHからのヒドリド(H–)と保存されたチロシン残基からプロトンによってC17=C18二重結合が還元されます。なお、この研究は、伊藤繁名誉教授(名古屋大学)と民秋均教授(立命館大学)と共同で行われました。
2)2つのプロトクロロフィリド還元酵素系の生理学
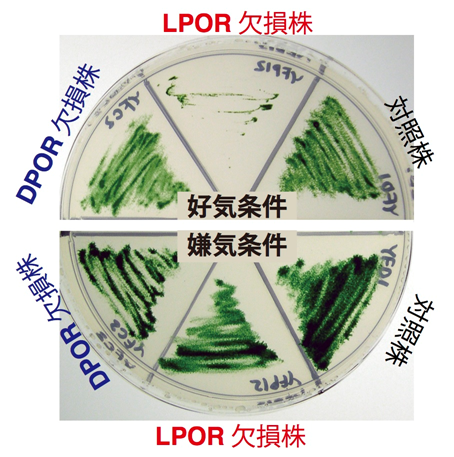
LPOR欠損株は、強光・好気条件では生育できませんが、同じ強光条件でも嫌気条件なら生育できます。このことは、DPORが酸素に弱い性質をもつこと、その性質をLPORが相補していることを示しています。
シアノバクテリアを始め、多くの緑藻、コケ、シダ、裸子植物は、DPORに加えて、光依存的にPchlideを還元する酵素LPORをもっています(図1.1)。LPORは、光に依存してPchlide還元反応を触媒しますが、どうして、同じ反応を触媒する酵素が一つの生物に2つも併存するのか、よくわかっていません。藤田は、この理由を探るため、シアノバクテリアLeptolyngbya boryana (Plectonema boryanum) において2つのPchlide還元系のいずれか一方を欠失した変異株を単離しました。これらの変異株の生育特性から、2つの還元系が部分的に機能分化していることを明らかにしました(Fujita et al. 1998)。LPORを欠くと、弱光ではほとんど形質が認められませんが、強光・好気条件では生育できなくなります(図1.5上)。また、DPORを欠くと暗所でクロロフィルを作ることができなくなります。このような部分的な機能的分業は、2つのPchlide還元系の生化学的性質(LPORは光が必要、DPORは酸素に弱い)をうまく活用また相補することにより、いかなる生育条件下でもクロロフィルが滞りなく合成されることを可能としていると推測されます。
LPOR欠損株は強光・好気条件では生育できませんが、強光条件でもあっても嫌気条件であれば生育でき(図1.5下)、O2レベルの上昇につれて生育が滞り、生育できる最高のO2レベルは3%でした。このことは、DPORが酸素によって不活性化されてしまうという性質をもつことを示唆しており、実際、粗抽出液でのDPOR活性は酸素にさらすことにより急速に失われることが確認されました(Yamazaki et al. 2006)。
文献
Fujita, Y., Takahashi, Y., Chuganji, M. and Matsubara, H. (1992) The nifH-like (frxC) gene is involved in the biosynthesis of chlorophyll in the filamentous cyanobacterium Plectonema boryanum. Plant Cell Physiol. 33, 81-92.
Muraki, N., Nomata, J., Ebata, K., Mizoguchi, T., Shiba, T., Tamiaki, H., Kurisu, G. and Fujita, Y. (2010) X-ray crystal structure of the light-independent protochlorophyllide reductase. Nature 465, 110-114.
Reinbothe, C., El Bakkouri, M., Buhr, F., Muraki, N., Nomata, J., Kurisu, G., Fujita, Y. and Reinbothe, S. (2010) Chlorophyll biosynthesis: spotlight on protochlorophyllide reduction. Trends Plant Sci. 15, 614-624.
藤田祐一 (2011) 暗所作動型プロトクロロフィリド還元酵素〜ニトロゲナーゼとの構造的類似性から見る酵素の多様性と進化〜 生化学 83, 642-647.
Fujita, Y., Takagi, H. and Hase, T. (1998) Cloning of the gene encoding a protochlorophyllide reductase: the physiological significance of the co-existence of light-dependent and -independent protochlorophyllide reduction systems in the cyanobacterium Plectonema boryanum. Plant Cell Physiol. 39: 177-185.
Yamazaki, S., Nomata, J. and Fujita, Y. (2006) Differential operation of dual protochlorophyllide reductases for chlorophyll biosynthesis in response to environmental oxygen levels in the cyanobacterium Leptolyngbya boryana. Plant Physiol. 142, 911-922
Nomata, J., Kondo, T., Mizoguchi, T., Tamiaki, H., Itoh, S. and Fujita, Y. (2014) Dark-operative protochlorophyllide oxidoreductase generates substrate radicals by an iron-sulphur cluster in bacteriochlorophyll biosynthesis. Sci. Rep. 4, 5455