研究内容
主な研究テーマ
植物は環境変化に応答して、代謝と形態形成の協調的な制御や、地上部と根系の成長調節を行なうことで個体としてのバランスを最適化しています。この調和のとれた環境応答を実現するためには、細胞間、器官間での情報の交換と統合が必要であり、植物ホルモンやペプチド、RNAなど様々な分子が情報の担い手(情報分子)としての役割を果たしています。しかし、その情報分子の生合成や輸送制御のしくみはまだよくわかっていません。私達は栄養環境応答において情報分子として働く植物ホルモンやその他の分子の役割に焦点を当て研究を進めています。特に植物成長の促進制御に働くサイトカイニンは、代表的な器官間情報伝達分子であり、植物の生産性向上を考える上でも重要な植物ホルモンであることから、当研究室の主要研究対象となっています。
キーワード:シロイヌナズナ, サイトカイニン, 窒素情報伝達, イネ, 植物ホルモン、細胞内小胞輸送
- サイトカイニン生合成と輸送およびその制御システムの解明
- 栄養状態の器官間コミュニケーション機構の解明
- 植物病原菌が生産する新奇サイトカイニンの同定と機能の解明
- PATROL1における細胞内小胞輸送とメリステムサイズ制御機構の解明
1.サイトカイニンの生合成・輸送調節機構の研究
サイトカイニンは、オーキシン存在下で細胞分裂を促進する物質の総称で、植物ホルモンのひとつに数えられています。その活性が報告されてから現在までの半世紀以上にわたる研究から、サイトカイニンは形態形成や窒素栄養の情報伝達など植物の多くの生命現象に関与していることが明らかにされています。植物の「生き様」を理解しようとする植物科学において、サイトカイニンの代謝や生理機能およびその作用機構を解明することは学術的に重要な課題です。また一方で、植物の形態形成や窒素栄養は、農作物の生産性を非常に大きく左右する要因でもあります。したがってサイトカイニン研究は、農作物生産に直結する知見も私たちに与えてくれます。
サイトカイニンの機能発現は三つの段階、すなわち、サイトカイニンの代謝(生合成・不活性化)、輸送(膜輸送系による短距離輸送・維管束系による長距離輸送)、情報伝達機構(受容・情報伝達・遺伝子機能調節)により制御されています。私たちはこれまでに生合成と輸送に関わる鍵遺伝子群を他に先駆けて同定しています(参考総説:Osugi and Sakakibara 2015)。現在、それら遺伝子群の機能と発現調節機構の解明研究を行っています。
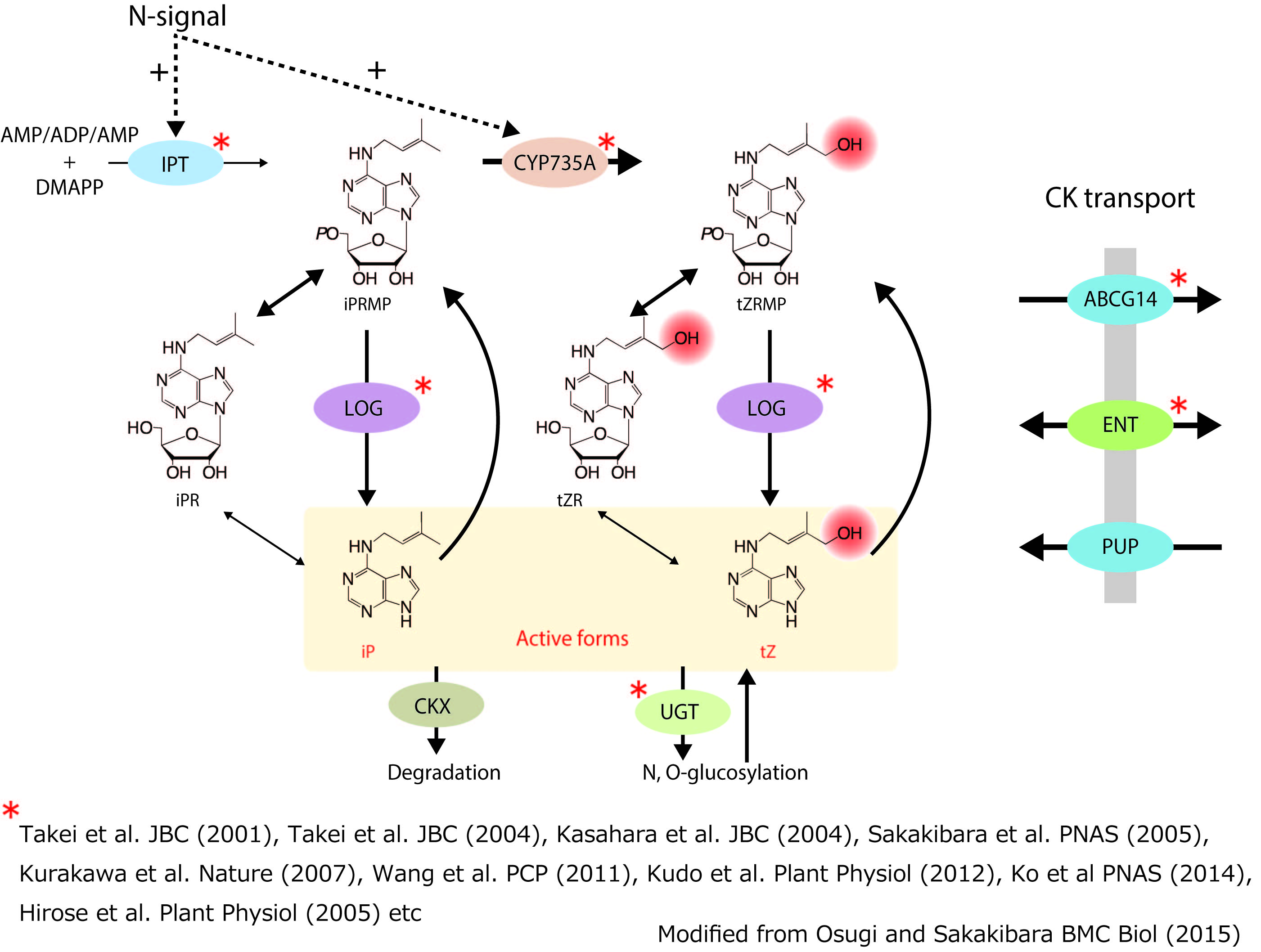
(図1)サイトカイニンの生合成経路と輸送体
2.栄養状態の器官間コミュニケーション機構の解明
植物は根圏の無機栄養と大気中のCO2から全ての生体構成分子を作り出していますが、無機栄養の供給は常に一定とは限りません。植物は栄養環境に応答して、代謝システムと形態形成の協調制御と、地上部と根系の成長調節を行ない、個体としてのバランスを最適化しています。この調和のとれた環境応答を実現するためには、細胞間、器官間での栄養情報の相互交換と統合が必要で、植物ホルモンや生理活性型ペプチド、その他の代謝物がシグナル分子として働いています。植物(作物)の生産性は栄養環境に大きく影響を受けることから、このしくみを理解することは植物科学の重要課題の1つといえます。
私達は栄養環境応答における器官間コミュニケーション機構について、植物ホルモンなどのシグナル分子の役割に焦点を当て研究を進めています。中でもサイトカイニンは、道管や篩管を介して長距離輸送される器官間情報輸送分子として重要な役割を持つことが知られています。私たちはサイトカイニンを中心に、植物体内における栄養情報の長距離輸送と作用調節のしくみについて研究を進めています(Kiba et al. 2013; Osugi et al. 2017)。
また、最近、鉄栄養応答においても器官間の情報コミュニケーションによって、鉄吸収に関わる遺伝子の発現調節が行われていることがわかったことから、この分子機構に関わる研究も進めています。
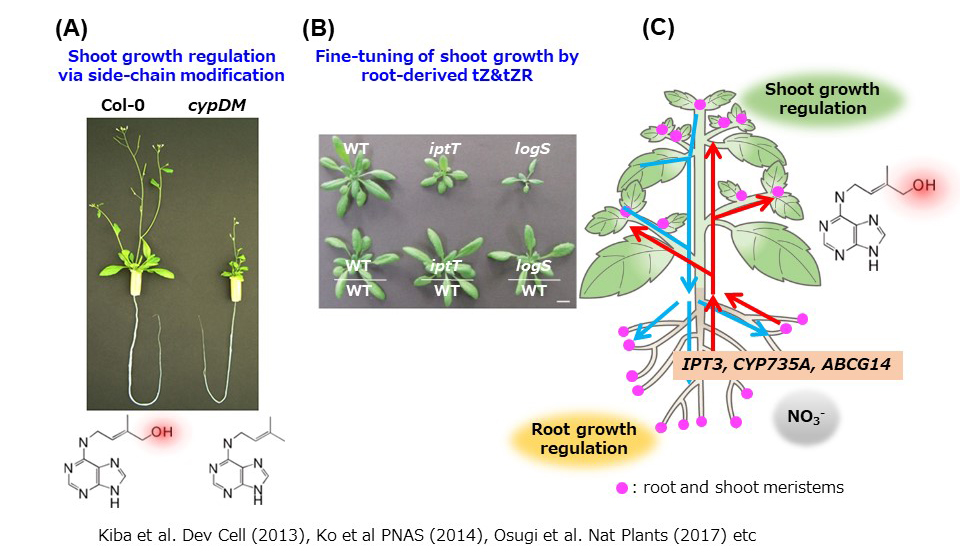
(図2)サイトカイニンの長距離輸送を介した成長調節
(A)tZ型サイトカイニンが合成できない変異体(cypDM)では、地上部の成長が著しく悪化する。
(B)根で合成されたtZ型サイトカイニンによって地上部の成長が調節される。
(C)栄養環境応答におけるサイトカイニンの生合成・輸送を介した成長調節のモデル
3.植物病原菌が生産する新奇サイトカイニンの同定と機能の解明
植物だけでなく、病原性土壌細菌の中にもサイトカイニンを合成するものがあります。それらの細菌は、植物に感染し、サイトカイニンを大量合成することで、様々な病症を示します。例えば土壌細菌の一種であるアグロバクテリウムは植物に感染すると、自身が持つTi-プラスミド上のT-DNA領域を植物細胞の核ゲノム中に組み込む性質があります。T-DNA領域にはサイトカイニンとオーキシンの合成酵素遺伝子がコードされており、これらが過剰に作り出されることで正常な細胞分裂制御が行えなくなり、植物細胞はコブ(クラウンゴール)をつくります。私たちは、このコブを作るメカニズムの一端として、アグロバクテリウムがサイトカイニン合成酵素である「Tmr」を感染植物のプラスチド内に送り込むことで植物本来のサイトカイニン合成径路を改変し、植物に高活性型のサイトカイニンを効率よく作らせていることを明らかにしました(Sakakibara et al. 2005, Ueda et al. 2012)。これは細菌による植物細胞の代謝機能改変戦略を分子レベルで明らかにした画期的な研究成果です。
また、Rhodococcus fasciansという植物病原菌は、植物がもたない新奇のサイトカイニン様物質を合成し、それが感染時の病症発現に重要な働きをしていることも明らかにしつつあります(Rhadika et al. 2015)。私たちは植物病原が作り出す構造未知の新奇サイトカイニン様物質の同定と、その機能の解明にもチャレンジしています。
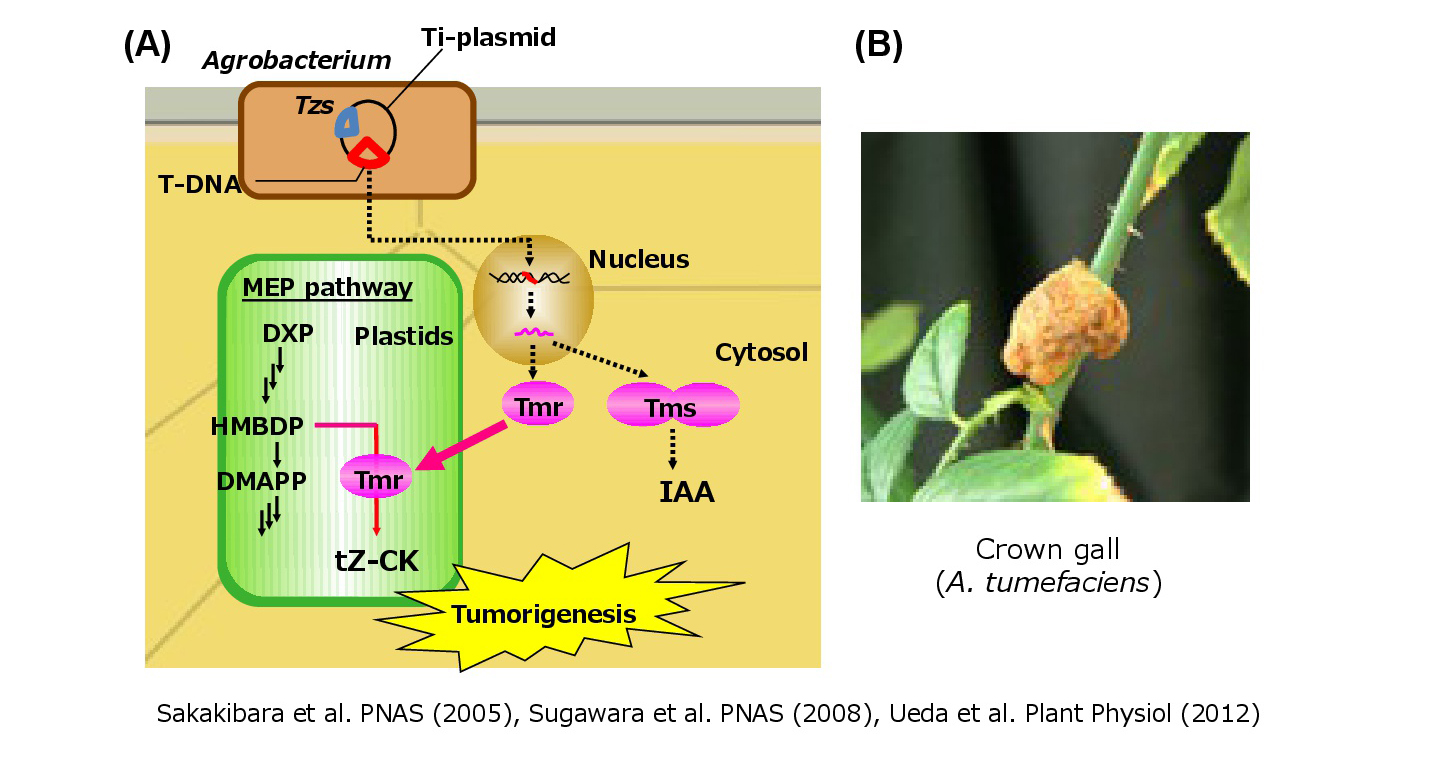
(図3)アグロバクテリウムは植物に高活性型サイトカイニンを合成させる。
(A) アグロバクテリウムがサイトカイニン合成酵素Tmrを感染植物のプラスチド内に送り込む。
(B)アグロバクテリウムが植物に感染した際に形成されるクラウンゴールの写真
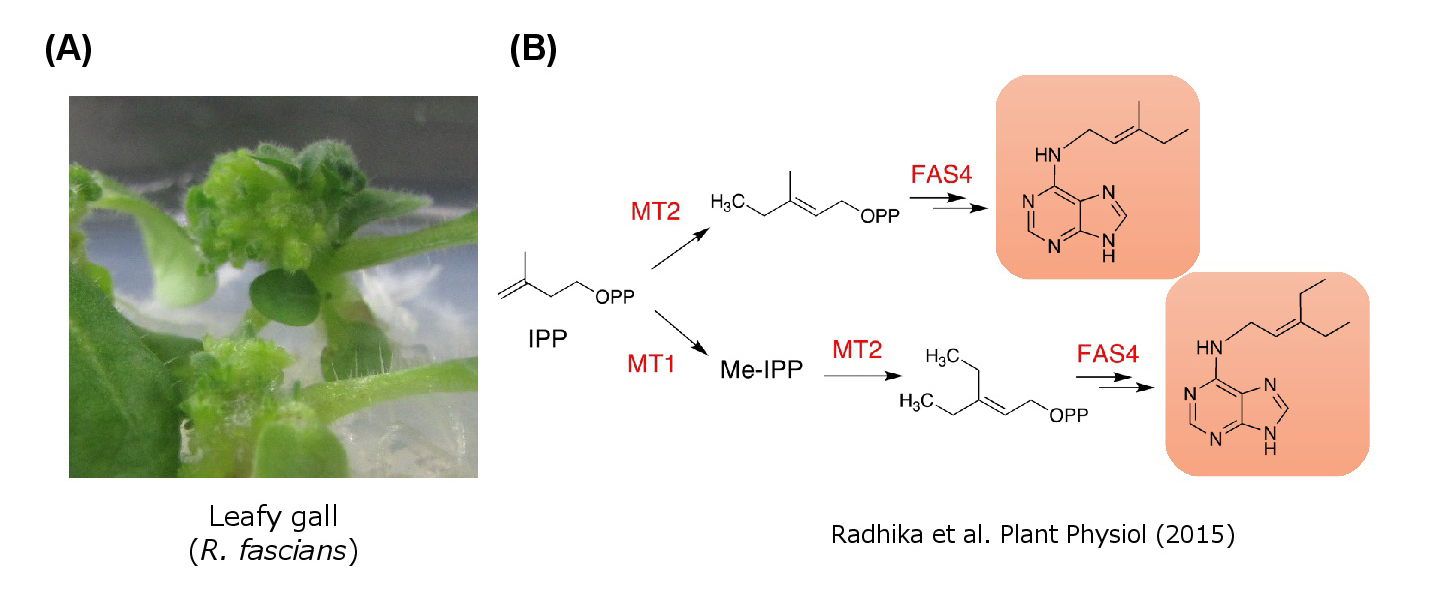
(図4) 植物病原菌Rhodococcus fasciansは植物がもたない新奇のサイトカイニン様物質を合成する。
(A)R. fasciansが植物に感染した際に形成されるLeafy gallの写真
(B)R. fasciansにおけるサイトカイニン様物質の生合成経路
4.PATROL1における細胞内小胞輸送とメリステムサイズ制御機構の解明

(図5) patrol1(proton-ATPase control 1)変異体の発見と、PATROL1遺伝子の機能解析の概要
(A)CO2濃度変化に応じた気孔の開度変化をサーモグラフィーでモニターするシステムの開発(B)気孔のCO2応答性突然変異体(high leaf temperature 1, 2)の単離
(C)patrol1変異体(ht2)の根は短い
(D)PATROL1はMUNドメインを持つタンパク質である
(E)MUNドメインは動物において細胞内小胞輸送に関与し、SNARE complexの形成を促進する
(F)PATROL1が関わる小胞輸送のターゲットは孔辺細胞と根で異なる
植物の葉の表面には気孔が存在し、ガス交換の出入り口になっています。CO2濃度の変化によって気孔の開度が変化することから植物にはCO2センサーがあると考えられていました。気孔が開くと蒸散による気化熱が発生し、葉の温度が下がります。私たちはサーモグラフィーによって間接的に気孔開度をモニターし、初めて気孔のCO2応答に関わる変異体を単離しました(Hashimoto et al. Nat. Cell Biol. 2006, Hashimoto-Sugimoto et al. Nat. Commun. 2013. 図6A, B)。最初に単離した変異体はht1(high leaf temperature 1)で、この原因遺伝子HT1はリン酸化酵素をコードしており、活性とCO2応答性に相関があること、CO2特異的に働く重要な鍵酵素であることがわかりました(Hashimoto et al. Nat. Cell Biol. 2006., Hashimoto-Sugimoto et al. J. Exp. Bot. 2016)。
一方ht2変異体(のちにpatrol1と改名)は気孔開口が難しく、個体サイズが小さい変異体でした(Hashimoto-Sugimto et al. Nat. Commun. 2013, Higaki et al. Plant Cell Physiol. 2014, 図6C)。この原因遺伝子がコードするPATROL1は生物界で広く保存されているMUNドメインを持っていると予想されました(図6D)。MUNドメインを持つタンパク質として知られる動物のMunc13やunc13は神経伝達物質を含む分泌小胞を細胞膜へ結合させるのに必要であり、MUNドメインにはSNARE complex の形成を促進する働きがあります(図6E)。patrol1変異体の孔辺細胞の細胞膜では気孔開口の駆動力となるH+-ATPase (AHA1)の量が低下していたことから、PATROL1はAHA1を孔辺細胞の細胞膜へ局在化させるのを促進する働きがあると考えられました(Hashimoto-Sugimoto et al. Nature commun. 2013)。
PATROL1は根でも強く発現しており、変異体ではメリステムサイズが小さい(Notaguchi et al. Planta 2024)。H+-ATPaseは細胞の伸長にもかかわるため、根の細胞膜においてもでもAHA1の量が変化していることが予想されましたが、AHA1の量は野生株と変わらず、根で主要な働きを持つAHA2においても存在量に違いは見られませんでした(Notaguchi et al. Planta 2024, 図6F)。このため、PATROL1がメリステムサイズの決定にどのような分子メカニズムを介して関与するのかを明らかにしようとしています。
PATROL1はバイオマスに影響を与えるため(Sugimoto-Hashimto et al. Nature Commun. 2013, Kimura et al. J.Exp.Bot. 2020)、PATROL1が介する細胞内小胞輸送の分子機構の解明は作物の高収量化、緑化による環境保全に向けた分子育種実現の可能性を持っています。
Hashimoto M, Negi J, Young J, Israelsson M, SchroederJI, Iba K. (2006) Arabidopsis HT1 kinase controls stomatal movements in response to CO2. Nat. Cell Biol. 8(4) 391-U52.
Hashimoto-Sugimoto M, Higaki T, Yaeno T, Nagami A, Irie M,, et al. (2013) A Munc13-like protein in Arabidopsis mediates H+-ATPase translocation that is essential for stomatal responses. Nat. Commun. 4 1038/ncomms3215.
Higaki T, Hashimoto-Sugimoto M, Akita K, Iba K, Hasezawa S. (2014) Dynamics and Environmental Responses of PATROL1 in Arabidopsis Subsidiary Cells. Plant Cell Physiol. 55(4) 773-780.
Hashimoto-Sugimoto M, Negi J, Monda K, Higaki K, Isogai Y,et al. (2016) Dominant and recessive mutations in the Raf-like kinase HT1 gene completely disrupt stomatal responses to CO2 in Arabidopsis. J. Exp. Bot. 67(11) 3251-3261.
Kimura H, Hashimoto-Sugimoto M, Iba K, Terashima I, Yamori W. (2020) Improved stomatal opening enhances photosynthetic rate and biomass production in fluctuating light. J. Exp. Bot. 71(7) 2339-2350.
Notaguchi M†, Ichita M, Kawasoe T, Monda K, Kurotani KI, Higaki T, Iba K, Hashimoto-Sugimoto M†. (†: Co-Corresponding auther)(2024) The PATROL1 function in roots contributes to the increase in shoot biomass. Planta 260(5).
