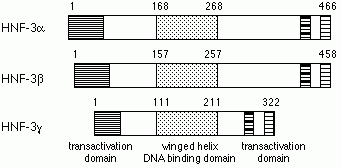
HNF-3b遺伝子の発現は、それ自身とHNF-6により制御されている。HNF-3bは、肝臓初期発生の最初に発現する肝臓特異的転写因子であり、その発現はマウス胎生6.5日の頭側の原条付近の内胚葉、外胚葉、中胚葉で最初に見られ、続いて結節、脊索、神経底板で見られ、胎生7.5日の前腸内胚葉で発現が見られ後に、胎生9-9.5日の肝臓原基で発現が見られるようになる。HNF-3bノックアウトマウスは結節、脊索が欠損し、発生初期に死んでしまう。
HNF-3a遺伝子の発現もHNF-3自身により調節されている。HNF-3bの強制発現によりHNF-3aの遺伝子発現が誘導され、HNF-3gノックアウトマウスではHNF-3aとHNF-3bの遺伝子発現が誘導させれことより、3つのアイソフォームが互いに調節しあっているようである。HNF-3aの発現は胎生8日に腹側内胚葉で見られ、胎生8.5日には前腸、後腸で見られ、胎生9-9.5日には肝臓原基、腸、神経底板で見られるようになる。HNF-3aノックアウトマウスは、生まれてくるものの成長抑制が見られ、低血糖のため2週間ほどで死んでしまう。HNF-3aはグルカゴン遺伝子の転写に必要であり、グルカゴンの低下のため低血糖により死に至るようである。
HNF-3g遺伝子はHNF-1bによりその発現が調節されている。発生時のHNF-3gの発現は、胎生8.5日の後腸と心臓中胚葉に接した内胚葉で最初に見られ、続いて肝臓原基で見られる。HNF-3gノックアウトマウスは、発生、生殖など正常で、一部の肝臓特異的遺伝子発現の低下が見られるが、先に述べたようにHNF-3a、HNF-3bの遺伝子発現が誘導されることによりHNF-3gの欠損を補償しているようである。HNF-3gには肝細胞増殖を抑制する作用が報告されている。
インスリンの情報伝達にHNF-3が関与する可能性が報告されている。HNF-3はPEPCK遺伝子のインスリン応答配列に結合することが明らかになり、線虫で同定された寿命に関与する遺伝子daf-2がインスリン受容体のホモログであり、daf-2の作用発現に関与する因子がHNF-3の仲間のdaf-16であることが明らかとなった。また、近位内胚葉に分化させた胚性幹細胞において、インスリンがHNF-3a遺伝子の発現を負に制御し、HNF-3b遺伝子発現を正に制御することが明らかとなった。一方、HNF-3bはHNF-1a遺伝子の発現を制御することが知られており、HNF-1aがMODY3であることから推測されるように、糖尿病との関連が知られている。
rat HNF-3a, FoxA1a; mouse HNF-3a, Foxa1; human HNF-3a, FOXA1
rat HNF-3b, FoxA2; mouse HNF-3b, Foxa2
rat HNF-3g, FoxA3; mouse HNF-3g, Foxa3
Kaestner, K. H., Knochel, W., and Martinez, D. E. (2000) Genes & Development 14: 142-146.