C/EBP
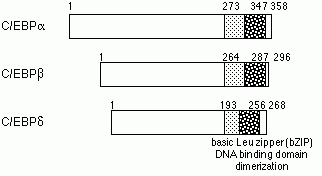
C/EBPは塩基性アミノ酸の領域とロイシンジッパーを持ったbZIPタンパク質であり、異なった遺伝子にコードされたC/EBPa、C/EBPb、C/EBPd、C/EBPg、CRP1、CHOPからなるC/EBPファミリーを構成している。C/EBPaは脂肪細胞や肝細胞の最終分化に関与することが知られている。また、C/EBPb、C/EBPdは急性期反応に重要な転写因子である。注目されるC/EBPaの機能として細胞増殖抑制作用が上げられる。C/EBPaはp21(サイクリン依存的キナーゼの阻害タンパク質)を介して細胞周期を止めている。また、Mycとの相互作用も報告されている。C/EBPa、C/EBPb、C/EBPdはそれ自身でそれ自身の遺伝子発現を調節している。C/EBPa遺伝子発現は、マウス胎生13日から見られる。C/EBPaノックアウトマウスは、生後8時間以内に低血糖のため死んでしまう。このマウスでは、肝臓にグリコーゲンを蓄積することができず、肝臓や脂肪組織に脂肪を蓄積することもできない。この原因として、肝臓におけるグリコーゲン合成や糖新生に関わる酵素の遺伝子発現の低下や、褐色脂肪組織におけるUCP遺伝子の発現低下が考えられる。また、C/EBPaノックアウトマウスでは、尿素回路酵素群の低下に伴う高アンモニア血症も見られた。C/EBPaノックアウトマウスでは正常な急性期反応が見られず、C/EBPaも急性期反応に必要な転写因子であることが分かった。
C/EBPb mRNAからは、翻訳開始点の異なるアイソフォーム(LIP)がつくられ、LIPは転写活性化ドメインを持っていないためC/EBPの阻害タンパク質として働く。C/EBPbノックアウトマウスでは、生まれた半数のマウスは正常な血糖値であるが、半数は糖新生の異常により低血糖が見られる。このマウスでは、マクロファージの機能にも異常が見られる。C/EBPbは、70%肝切除後に急激な増加が認められており、増殖との関連が推定されたが、C/EBPbノックアウトマウスでは、肝切除後の肝細胞増殖が抑制されており、C/EBPbが正常な肝細胞の増殖に必要であることが明らかとなった。
Updated 3/8/2K
