水田に供給される有機物の種類とその量
1)雑草量、藻類量
2)リター量、根量
3)刈り株・残根量
水田における植物遺体の分解
1)植物遺体の分解過程に見られる規則性
2)植物遺体は1〜2 mmに細分化されるまでに半量近くが分解
水稲によって光合成された有機物の土壌中の動態
1)収穫期における光合成由来の有機物の土壌中における分布
2)光合成由来の有機物を利用して増殖した土壌微生物
3)収穫後の刈り株や残根の分解にともなう土壌微生物の増殖
水田の肥沃度は、土壌へ還元される有機物の量によって左右されるといっても過言ではない。古来農民は、刈敷き、畦畔雑草、堆厩肥、糞尿、河川や湖沼の低泥など可能な限りの有機物を水田に還元し、水田肥沃度の維持に努めてきた。ひるがえって化学肥料万能の現在、水田へ還元される有機物量は水稲刈り株や残根、稲ワラなどに限られ、堆厩肥の施用は少数の篤農家水田で実施されているのみであるが、他方で畜産廃棄物量は増加の一途をたどり、農業セクターにおける合理的な有機物管理の方策確立が急務となっている。
本報告は、水田への各種有機物の供給と分解、その土壌微生物群集への影響を紹介するものであり、水田圃場に還元される各種有機物の種類と量を旧農林水産省農業研究センター鴻巣試験地水田を例に紹介するとともに、活発な各種植物遺体の分解の状況、加えて、作物残渣(稲ワラ)の土壌への還元が土壌肥沃度を向上させるのみならず、水田生態系の微生物多様性にも寄与していることを紹介する。
水田の肥沃度維持・増進、水稲の安定多収のためには、合理的な有機物管理が不可欠であり、そのためには水田における有機物の供給と分解の実態を定量的に把握することが不可欠である。その実態の定量的認識はまた、現在直面している「農業セクターにおける有機物問題」の解決に大いに寄与するであろう。なお、本報告は、これまでに水田における有機物負荷量と水田土壌中における炭素動態を紹介した3つの総説を基にしたものである(木村・高井 1984;Kimura et al. 2004;木村 2005)。
水田に供給される有機物の種類と量は、水田の管理方法によって異なる。ここでは、大正15年に試験が開始された旧農林水産省農業研究センター鴻巣試験地(埼玉県鴻巣市:北緯36ー3ユ,
東経139ー31ユ)に設けられた4種の長期肥料連用試験水田圃場(無肥料区、無機質肥料区、緑肥区、有機質肥料区)で行われた研究を紹介する。試験開始以来、無肥料区水田は継続して無肥料で管理され、無機質肥料区水田へは化学肥料が、緑肥区水田へは化学肥料に加えてレンゲが、有機質肥料区水田へは化学肥料と堆肥が、それぞれ一貫して施用されてきた。施肥の種類と施肥量を表1に示す。表2は試験水田の作業管理を示したものであり、各種の農作業に伴って様々の有機物が水田に供給されていることがわかる。
| 区名 | N* | ダイズかす | P2O5* | K2O | 厩肥 | レンゲ | 石灰 | 肥料成分(kg/ha) | 肥料内容 | |||||
| 基肥 | 追肥 | N | P2O5 | K2O | N | P2O5 | K2O | |||||||
| 無肥料 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | - | - | - |
| 無機質肥料 | 63 | 42 | 0 | 50 | 100 | 0 | 0 | 0 | 105 | 50 | 100 | 硫安(Nとして63:42kgに分施) | 過石 | 硫加 |
| 緑肥 | 0 | 0 | 0 | 33 | 75 | 0 | 23000 | 1000 | 110 | 54 | 100 | レンゲ(Nとして110kg) | 過石 | 硫加 |
| 有機質肥料 | 0 | 0 | 600 | 25 | 50 | 12000 | 0 | 0 | 103 | 64 | 97 | ダイズかす(Nとして43kg),堆肥(Nとして60kg) | 不足分を過石 | 不足分を硫加 |
| 月 日 | 作業内容 | 添加有機物 |
| 5 8 | レンゲ刈取り | レンゲ |
| 9 | 堆肥運搬 | 堆肥 |
| 15 | 耕起 | 雑草(冬生) |
| 6 6 | 二番耕起 | 雑草(春生) |
| 16 | 湛水 | |
| 17 | 施肥、代かき | |
| 18 | 移植 | |
| 7 14 | 除草 | 雑草(水生) |
| 17 | 薬剤遮布(バイジェット乳剤) | |
| 30 | 中干し(8月7日まで) | 浮き草、藻類 |
| 31 | 薬剤遮布(バイジェット乳剤、バリダシン乳剤) | |
| 8 8 | 殺虫剤散布(ディプテレックス) | |
| 9 5 | 殺菌剤散布(ヒノザン乳剤) | |
| 15 | 落水 | 浮き草、藻類、雑草(水生) |
| 10 20 | 収穫(水稲) | 刈り株 |
1)雑草量、藻類量
当水田は一毛作のため、冬の間は休閑状態で放置され、冬生・春生雑草の量が二毛作田に比べて多いのが特徴である。春の耕起によって水田に鋤き込まれる雑草の量は、水田の来歴によって、170〜3400 kg/haと大きく異なっていた(図1,佐伯・山崎 1978;山崎・佐伯 1979, 1980)。なお、主要な雑草としてスズメノテッポウAlopecurus aequalis、ミズタカモジAgropyron humidorum OHWI & SAKAMOTO、コオニタビラコLapsana apogonoides MAXIM、スズメノカタビラPoa annua L. 等が観察されている(山崎・佐伯 1980)。
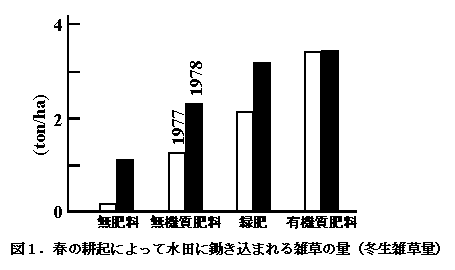
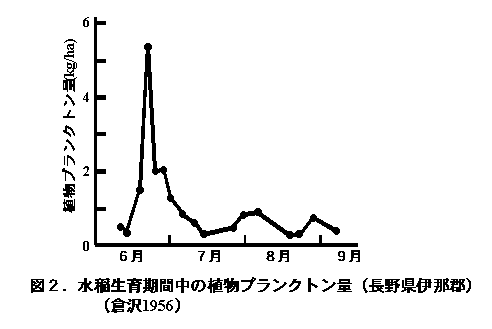
他方、水稲生育期間中の雑草重は、各種の除草作業の結果、60〜490 kg/haと休閑期の雑草量に比べて著しく少なかった(佐伯・山崎 1978;山崎・佐伯 1979, 1980)。雑草に加えて、表面水中に各種の藻類が生育し、緑肥区や有機質肥料区では水稲の生育初期にフシマダラPitophora oedogoniaの生育が旺盛で、その乾燥重量は50〜620 kg/haに達した(佐伯・山崎 1978;山崎・佐伯 1979, 1980)。同様の雑草量710 kg/haが東京田無の黒ボク水田でも観察されている(Yamagishi et al. 1980b)。なお、当水田におけるプランクトンの量は不明であるが、その量は雑草や緑藻の量に比べて極めて少ないものと推察される(図2,5〜6 kg/ha:Ichimura 1954;倉沢 1956)。
2)リター量、根量
水稲は生育期間中、新しい葉と根を順次伸長させる一方、古い葉は下葉から枯死・落葉させる(図3)。
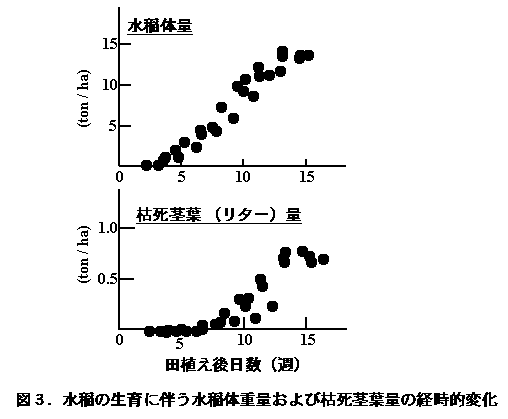
その結果、枯死葉の総量は収穫期までに700〜800 kg/haにも達し、水稲体生産量の約5%に相当していた(JIBP/PP-Photosynthesis Level I Experiment Report 1969, 1970, 1971)。他方、根は光合成有機物の一部を土壌中に分泌し、古い根は枯死・脱落していく。Lu et al.(2002b)は、ポット栽培した水稲に生育期間中数回13CO2を同化させ、その後収穫期に土壌から回収された各種有機物、微生物中の13Cの量を基に、根によって供給された土壌中の有機物の量が光合成量の3%以上に達すると推定した(図4)。
この値は、収穫期に土壌中に残存していた光合成由来の炭素の量から推定したものであり、収穫期までに土壌微生物によって分解された量は含まれていない。下限の値である。この結果を当水田に生育している水稲および雑草に準用するならば、その量は水稲で180〜330 kg/ha以上、雑草においては5〜102 kg/ha以上と推察された。なお、ここで推定した水稲根由来の土壌有機物量は、コムギにおける推定量710〜1020kgC/ha(Swinnen et al. 1994b)より少なかったが、オオムギ(188〜640kgC/ha: Hansson et al. 1991)や牧草(148〜449kgC/ha: Saggar et al. 1997)で得られた値に類似するものであった。
3)刈り株・残根量
収穫後水田に残される水稲刈り株と残根の総量は、600〜2250
kg/haに達し、その約70%が水稲刈り株であった(図5、今関 1917;岩田・奥田 1937;木村ら 1980)。なお、本圃場においては、すべての稲ワラが圃場外に搬出されていたが、近年は収穫にコンバインを使用する結果、細断された稲ワラが水田表面に残され、その量はおおよそ籾収量に相当することから、5〜6トン/ha程度と推定される。
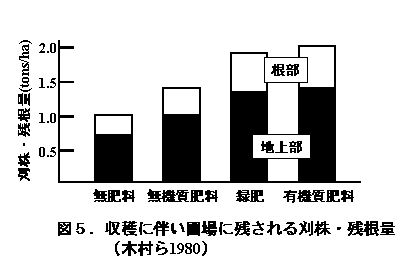
表3は以上の結果をまとめたものであり、各有機物について測定値の最大値と最小値で示した。本表から、次のような興味ある事実が浮かび上がる。
1)当水田に供給される有機物の総量は、施肥の違いにより、1.7〜8.8
ton/haと大きく異なる。
2) 緑肥や堆肥に由来する有機物量は1.5〜1.8
ton/haであり、年間に供給される有機物総量の2割弱に過ぎず、水稲の刈り株や残根、冬生・春生雑草の割合のほうが大きい。
3)当水田は一毛作であり、冬生・春生雑草量が二毛作の水田より多いことが特徴である。他方、二毛作の水田では、冬生・春生雑草に代わって裏作作物の収穫残渣が水田に供給され、その量は、作物の種類と施肥・管理の違いによって異なるものと推察される。
表3.水田における有機物供給量(kg/ha/年)
|
|
|
|
|
|
| 雑草(冬・春生)鋤込み |
|
|
|
|
| 雑草(冬・春生)分泌物 |
|
|
|
|
| 水生雑草(除浮き草) |
|
|
|
|
| 水生雑草(浮き草) |
|
|
|
|
| 藻類 |
|
|
|
|
| 水稲落葉(リター) |
|
|
|
|
| 水稲根分泌物 |
|
|
|
|
| 水稲刈り株 |
|
|
|
|
| 水稲残根 |
|
|
|
|
| 有機質肥料 |
|
|
|
|
|
|
|
|
|
|
このような有機物供給量の違いを反映して、各水田の土壌中の炭素の総量は毎年-71〜+325 kg/ha増減した(表4)。従って、1)の結果からするならば当水田は年間1.8〜8.5 ton/haの有機物を分解していると推察される。水田は、有機物の循環が活発に進行している生態系である。
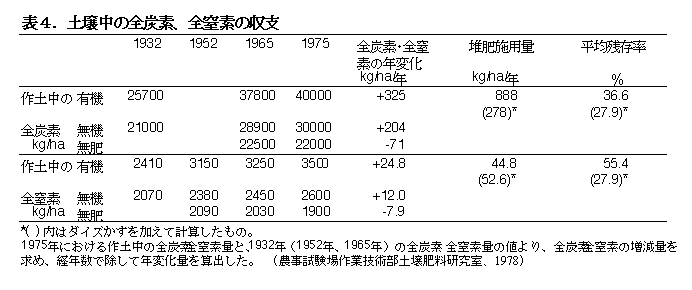
図6は、上述した旧農林水産省農業研究センター鴻巣試験地の長期肥料連用試験圃場のうち、有機質肥料区に供給される有機物(植物遺体)の種類と供給量、その時期、また存在部位を示したものであり、有機物の種類ごとの幅の広狭は、その相対的な量を表3から計算し図示したものである。当水田に供給される有機物は、その存在部位から、a)水生植物、リター(表面水–>土壌表面–>作土中)、b)水生雑草、水稲刈り株(土壌表面–>作土中)、c)冬生・春生雑草、堆肥・緑肥、根(作土中)の3種類に大別される。また、各種植物遺体の供給時期は5〜10月にわたって分布しており、その存在部位は圃場の管理作業によって変化した。

ところで、水田における有機物分解の観点から図6を眺めるならば、分解の主要な部位が、表面水、土壌表面、作土中に大別され、上述したa)、b)、c)の植物遺体はおのおの異なった分解過程をたどるとともに、各植物遺体の分解環境が季節によって変化することが解かる。また、表3や図6から、冬生・春生雑草、堆肥・緑肥、水稲刈り株が主要な植物遺体であることも納得できる。
1)植物遺体の分解過程に見られる規則性
先に紹介した旧農林水産省農業研究センター鴻巣試験地の長期肥料連用試験圃場において、1mm以上の大きさの植物遺体の量の季節変動は、無肥料区0.3〜2.5
ton/ha、無機質肥料区1.2〜3.7 ton/ha、緑肥区1.2〜6.2 ton/ha、有機質肥料区1.4〜4.8 ton/haであり、収穫(刈り株・残根)および春の耕耘(冬生・春生雑草)にともなって土壌中の植物遺体量が増加していた(木村ら
1980)。
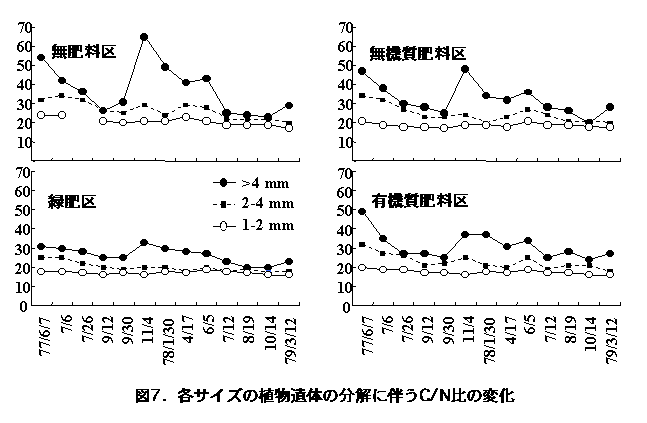
植物遺体は分解に伴って形態が小さくなる。4
mm, 2 mm, 1 mmのフルイを用いて、各フルイ上に回収された植物遺体の炭素と窒素の比(C/N比)を測定したところ、4 mm以上の植物遺体>2〜4
mmの植物遺体>1〜2 mmの植物遺体の順に、形態が小さくなるほどC/N比が低下し、1〜2 mmの植物遺体では年間を通じてC/N比が15〜20の範囲で安定し、その値は、無肥料区20.7 ± 2.1、無機質肥料区18.8 ± 1.2、緑肥区17.2 ± 1.0、有機質肥料区17.5 ± 1.3であった(図7、木村ら 1980)。
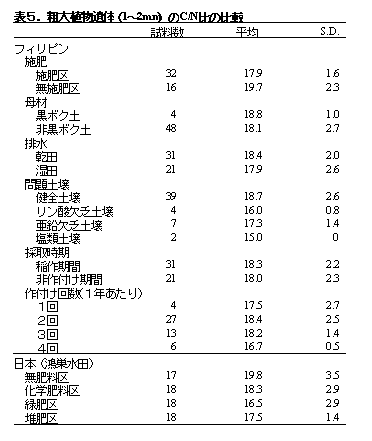
興味あることに、フィリピン(32点)とタイ(33点)の水田から回収した1〜2 mmの大きさの植物遺体のC/N比も、フィリピン土壌18.0±2.1、タイ土壌20.3±2.6で、日本の水田から回収した1〜2 mmの植物遺体のC/N比の値と類似していた(表5、Kimura et al. 1990)。このように、土壌の種類、施肥、管理、試料採取時期、気候帯(熱帯と温帯)などに関し、互いに異なる多数の水田から植物遺体を回収し、その中には、泥炭土壌、年間3回も水稲を栽培する水田、また水稲栽培期や休閑期の水田も含まれ、雑草、刈り株、稲ワラ、水稲根、原植生の植物遺体(泥炭土壌の場合)が様々の割合で混在していたにもかかわらず、1〜2 mmの大きさの植物遺体のC/N比がいずれも17〜21であったことから、起源の異なる植物遺体も水田土壌中で共通した分解過程を辿るものと考えられる。
2)植物遺体は1〜2 mmに細分化されるまでに半量近くが分解
稲ワラのような植物遺体は、土壌中で微生物分解を受けると、そのC/N比が低下する。これは、稲ワラにはセルロースやリグニンなど炭素が多く含まれC/N比が60近い高い値であるのに比らべ、微生物の体は主にタンパク質で構成されC/N比が5近い極めて低い値であるために、微生物分解に伴って稲ワラの炭素量が減少する一方、稲ワラ上に生育してきた微生物体内の窒素の量が増加し、その結果回収した稲ワラ(多くの微生物が生育)の見かけのC/N比が低下するためである。そこで、水田土壌中に鋤き込まれた植物遺体が、1 mm程度の大きさになるまでにどれ程の微生物分解を受けたかを推定した。表6には、分解過程の植物遺体のC/N比をできるだけ高く維持するような様々に極端な条件を挙げ、C/N比の分解に伴う変化を計算した(木村ら1980)。すなわち、微生物の増殖効率(稲ワラ分解量に対する微生物体生産量の割合)を20〜30%(通常は10%以下)、植物遺体の分解に関与した微生物が土壌から回収した植物遺体上にほとんど存在、植物遺体の分解に関与した微生物は必要とする窒素を主に土壌中から獲得(植物遺体中の窒素は主にタンパク質であり容易に利用可能だが)等の仮定の下で、植物遺体として稲ワラ(C/N = 60)と窒素含量の高い雑草(C/N = 30)を例に、これら植物遺体が40、50、60%分解されるとC/N比がどのように変化するかを試算した。

その結果、40〜50%分解した時点での各植物遺体のC/N比が、ちょうど1〜2 mmの大きさの植物遺体のC/N比に相当することが判明した(表6)。従って、水田土壌中で植物遺体が分解し、1mm程度の大きさになるまでに、植物遺体の炭素の量は(炭素量は有機物量のほぼ半量なので、有機物量も)その約50%がすでに分解されていると推察される。植物遺体が1 mm程度の大きさになる初期分解の過程は極めて活発な分解の段階である。
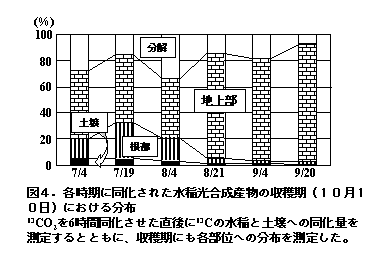
植物根は土壌から無機養分を吸収するばかりでなく、光合成した有機物の数%を根周辺の土壌に供給し、これらの有機物は、土壌中で植物遺体とは異なった分解過程(炭素循環)をたどる。図8は、水稲生育期間中に数回、13CO2を光合成させ、1)光合成された13Cの収穫期における分布、2)13Cを取り込んだ水稲の刈り株および残根を土壌に混和して240日間15度で培養した後の13Cの消失(分解)、土壌有機物や微生物体への取り込みの状況、さらに3)収穫期に土壌有機物や微生物バイオマスとして存在した13Cの15度240日間培養後に分解した割合、をまとめたものである(Lu et al. 2002a, 2002b, 2003, 2004;Watanabe et al. 2004)。
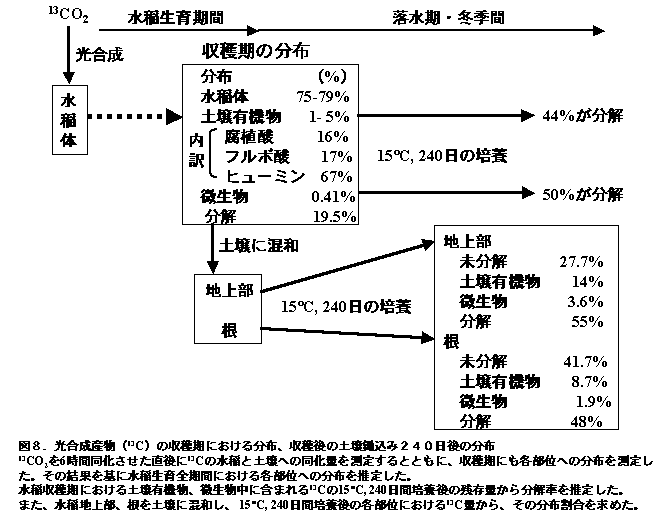
1)収穫期における光合成由来の有機物の土壌中における分布
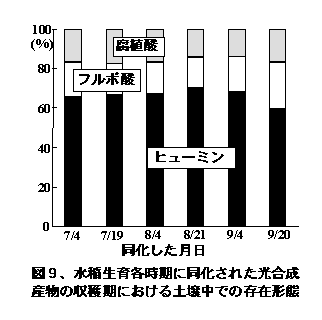
水稲のような穀類では、生育時期によって光合成産物は葉から体内各部位に異なった割合で運ばれる。図4は、生育各時期に13CO2を短時間水稲に同化させた後、収穫期における13Cの水稲地上部と根部、土壌中、未回収部分(分解)への分布割合を調べたものである。13CO2の分布は、吸収時期によって変化し、水稲地上部45〜90%、根部2〜28%、土壌1〜5%、分解8〜33%であった(Lu et al. 2002b)。一般に、水稲の生育に伴って水稲地上部への分配割合が増加し、その他の部位への割合が減少する。本結果からは、生育全期間におよそ200 kg/haの炭素が根から土壌に供給されたものと推察され、その多くがヒューミン様物質(アルカリに不要な土壌有機物)として収穫期の土壌中に存在していた(図9)。
2)光合成由来の有機物を利用して増殖した土壌微生物
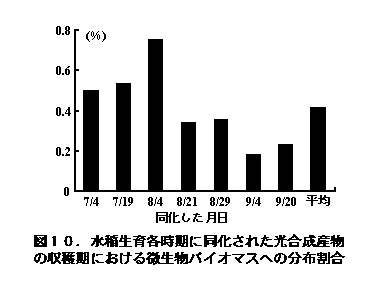
6時間の光合成直後に光合成された炭素の0.15〜0.94%(平均0.54%)がすでに微生物体内に取り込まれており、収穫期に至っても0.18〜0.75%(平均0.41%)の炭素が微生物体中に残存していた(図10)。この結果と収穫期における土壌中の微生物の量から、収穫期の微生物の約28%が根由来の有機物を利用して増殖した微生物と推定された(Lu et al. 2002a)。このように、水稲は生育期間中有機物を根周辺に供給し、土壌中の微生物の主要なエサとなっている。なお、同様な方法で2時間13CO2を水稲に同化させた1〜3時間後に、光合成産物に由来する13CH4が水稲体を経由して大気中へ放出されていることも知られており(Minoda and Kimura 1994)、水稲光合成産物は同化された後速やかに根部、続いて根周辺の土壌に移行し、根周辺に生育する微生物のエサとして利用されている。
3)収穫後の刈り株や残根の分解にともなう土壌微生物の増殖
収穫後、水田に残された刈り株と残根は、冬の間に一部分解し、微生物や土壌有機物に変化する。先の実験から得られた13Cを多く含む刈り株と残根を土壌に1.5%の割合で混合し、15˚C、240日間放置したところ、刈り株と残根はそれぞれ、72%、58%分解した(図11、Lu
et al. 2003)。
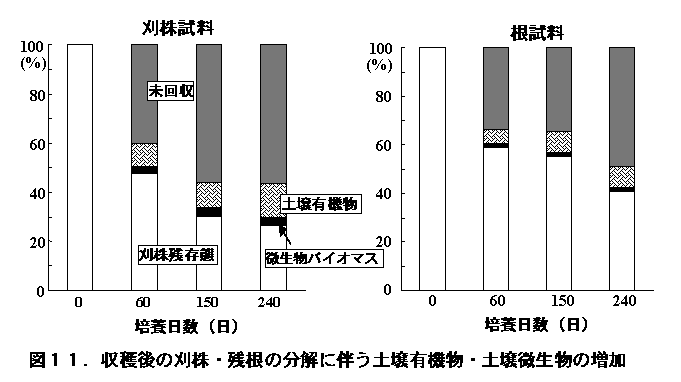
この分解にともなって、刈り株炭素の3.6%、残根炭素の1.9%が微生物体炭素に変化し、土壌中の微生物の39%(刈り株添加)〜23%(残根添加)を占めるに至った(図12)。
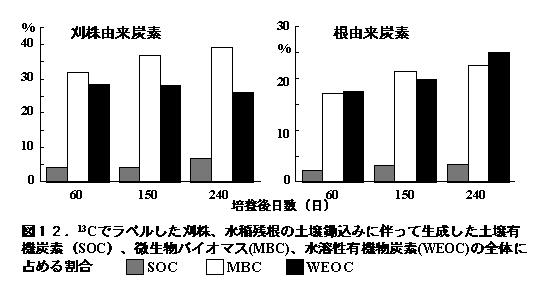
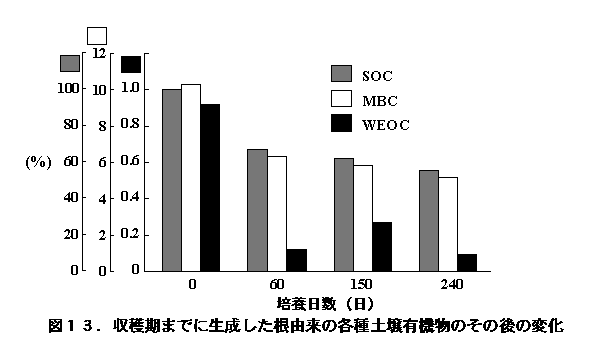
また、刈り株炭素の14%、残根炭素の8.7%が土壌有機物として回収された。他方、収穫期までに水稲の光合成産物を利用して増殖した微生物の50%が、240日間の培養期間に死滅するとともに、光合成産物を起源とする土壌有機物の44%が分解・消失していた(図13、Lu et al. 2003)。これらの結果は、稲刈り後の水田でも活発な植物遺体の分解が進行するとともに、土壌微生物が増殖と死滅を繰り返していることを示すものである。
水田生態系は、微生物に多様な生育環境を提供しており、土壌中の水稲残渣(稲ワラ)はその主要な生育環境の1つである。これまで著者らの研究室では、田面水、浸透水、湛水土壌、土壌中の稲ワラ、堆肥化過程の稲ワラ、湛水土壌中の稲ワラ堆肥等、水田生態系を構成するそれぞれの部位に生息する微生物群集の特徴を、リン脂質脂肪酸組成から明らかにしてきた。そこで、これまでに上記の各部位から得られたリン脂質脂肪酸組成のデータを比較することにより、稲ワラ(水稲残渣)に生息する微生物群集の特徴を明らかにし、“微生物多様性”の視点から評価した稲ワラ施用の意義を考察する。
供試した試料は、愛知県農業総合試験場安城農業技術センターの水田圃場から採取した試料、同センターの水田土壌のポット試験から得られた試料、田面水37点、浸透水29点、作土(湛水期19点、落水期2点)、土壌中の稲ワラ(湛水期51点、落水期10点)、堆肥化過程の稲ワラ12点、湛水土壌中の稲ワラ堆肥7点、稲ワラ5点の計172点である。各試料からメタノール−クロロホルム−リン酸緩衝液でリン脂質を抽出後、酸性条件下でメチル化し、リン脂質脂肪酸組成をガスクロマトグラフで定量した。リン脂質脂肪酸は、4つに大別され(飽和型脂肪酸、モノ不飽和型脂肪酸、ポリ不飽和型脂肪酸、分枝型脂肪酸)、モノ不飽和型脂肪酸はグラム陰性細菌、ポリ不飽和型脂肪酸は真核生物、分枝型脂肪酸はグラム陽性細菌の存在を示唆するとともに、分枝型脂肪酸中の18:2w6cは糸状菌の指標脂肪酸とみなされている。
各部位のリン脂質脂肪酸組成はそれぞれ特有のパターンを示し、採取時期による顕著な変動は認められなかった。図14は、リン脂質脂肪酸組成から見た稲ワラ分解に関与する微生物群集の特徴を見たものであり、稲ワラ材料、湛水土壌を比較のためにあわせて図示した。湛水土壌に鋤きこんだ稲ワラには多くの側鎖型脂肪酸が含まれ、グラム陽性細菌が優占していることが推察される。他方、落水期の稲ワラにはモノ不飽和脂肪酸が多く含まれ、グラム陰性細菌の優占が推察された。また、田面水にはグラム陰性細菌と藻類、浸透水にはグラム陰性細菌、水田土壌にはグラム陽性細菌と放線菌、稲ワラには糸状菌、堆肥化過程の稲ワラおよび湛水土壌に施用した稲ワラ堆肥にはグラム陽性細菌、がそれぞれ特徴的な微生物群集であった。図15は、各部位に生息する微生物群集をリン脂質脂肪酸組成のパターンを基に、クラスター分析により区分したものである。クラスターは、A1)田面水および浸透水、A2)土壌中の稲ワラおよび土壌中の稲ワラ堆肥、B1)湛水土壌中の稲ワラ、B2)土壌および堆肥化過程の稲ワラ、に区分され、例外は172試料中、わずかに5点であった。したがって、各部位に生育する微生物群集は、相互に特徴的でかつ安定に生息していると判断される。

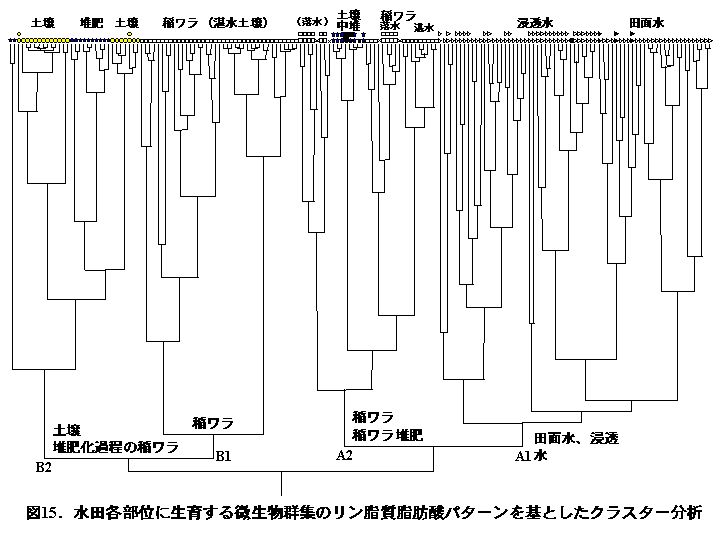
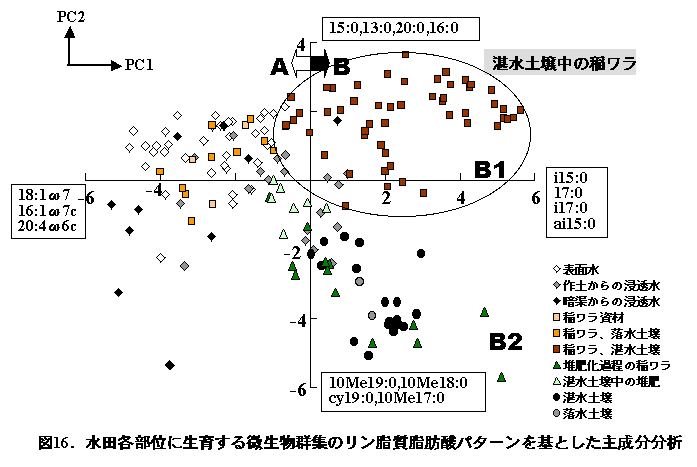
図16は、各部位の微生物群集を主成分分析により比較したものである。湛水土壌中の稲ワラに生育する微生物群集は第1象限に分布し、他方落水期の微生物群集は第2象限に分布して表面水中の微生物群集に類似するものであった。このように、稲ワラの湛水土壌中での分解に関与する微生物群集は、他の土壌部位には見られない特異な群集であり、稲ワラの水田への還元は、水田生態系における微生物群集の多様性の増大に寄与しているものと推察された。
文 献
Cahyani, V.R., Watanabe, A.,
Matsuya, K., Asakawa, S., and Kimura, M.: Succession of microbiota
estimated by phospholipid fatty acid analysis and changes in organic
constituents during the composting process of rice straw. Soil Science
and Plant Nutrition 48, 735-743 (2002)
Hansson, A.C., Andren, O.,
Steen, E.: Root production of four arable crops in Sweden and its
effect on abundance of soil organisms, In Plant Root Growth, an Ecological
Perspective, edited by D Atkinson, pp. 247-266, Blackwell, Oxford (1991)
Ichimura, S.: Ecological studies
on the plankton in paddy fields. I. Seasonal fluctuations in the standing
crop and productivity on plankton. Japanese Journal of Botany 14, 269-274.
(1954)
JIBP/PP-Photosynthesis, Local
Productivity Group: Photosynthesis and utilization of solar energy.
Level I Experiments. Report 2 Data collected in 1967. p.23. (1969)
JIBP/PP-Photosynthesis, Local
Productivity Group: Photosynthesis and utilization of solar energy.
Level I Experiments Report 3 Data collected in 1968. p.30. (1970)
JIBP/PP-Photosynthesis, Local
Productivity Group: Photosynthesis and utilization of solar energy.
Level I Experiments Report 4 Data collected in 1969. p.24. (1971)
Kimura, M., Kishi, H., Okabe,
A., and Maie, N.: Phospholipid fatty acid composition of microbiota
in the percolating water from a rice paddy microcosm. Soil Science and
Plant Nutrition 47, 533-545 (2001a)
Kimura, M., Miyaki, M., Fujinaka,
K., and Maie, N.: Microbiota responsible for the decomposition of rice
straw in a submerged paddy soil estimated from phospholipid fatty acid
composition. Soil Science and Plant Nutrition 47, 569-578 (2001b)
Kimura, M., Murase, J., and
Lu, Y.: Carbon cycling in rice field ecosystem in the context of input,
decomposition and translocation of organic materials and the fates of
their endproducts (CO2 and CH4). Soil Biol. Biochem., 36, 1399-1416 (2004)
Kimura, M., Watanabe, I., Patcharapreecha,
P., Panichsakpatana, S., Wada, H., and Takai, Y.: Quantitative estimation
of decomposition process of plant debris in paddy field. II. Amounts
and C/N ratios of plant debris in tropical paddy soils. Soil Science
and Plant Nutrition 36, 33-42. (1990)
Lu, Y., Watanabe, A., Kimura,
M.: Carbon dynamics of rhizodeposits, root- and shoot-residues in a
rice soil. Soil Biology and Biochemistry 35, 1223-1230 (2003)
Lu, Y., Watanabe, A., Kimura,
M.: Contribution of plant photosynthates to dissolved organic carbon
in a flooded rice soil. Biogeochemistry 71, 1-15 (2004)
Lu, Y., Watanabe, A., and Kimura,
M.: Contribution of plant-derived carbon to soil microbial biomass
dynamics in a paddy rice microcosm. Biology and Fertility of Soils 36,
136-142 (2002a)
Lu. Y., Watanabe, A., and Kimura,
M.: Input and distribution of photosynthesized carbon in a flooded
rice soil. Global Biogeochemical Cycles 16, 1085 (2002b)
Minoda, T. and Kimura, M.:
Contribution of photosynthesized carbon to the methane emitted from
paddy fields. Geophysical Research Letters 21, 2007-2010 (1994)
Nakamura, A., Tun, C.C., Asakawa,
S., and Kimura, M.: Microbial community responsible for the decomposition
of rice straw in a paddy field: estimation by phospholipid fatty acid
analysis. Biology and Fertility of Soils 38, 288-295 (2003)
Okabe, A., Oike, H., Toyota,
K., and Kimura, M.: Comparison of phospholipid fatty acid composition
in floodwater and plow layer soil during the rice cultivation period
in a Japanese paddy field. Soil Science and Plant Nutrition 46, 893-904
(2000a)
Okabe, A., Toyota, K., and
Kimura, M.: Seasonal variations of phospholipid fatty acid composition
in the floodwater of a Japanese paddy field under a long-term fertilizer
trial. Soil Science and Plant Nutrition 46, 177-188 (2000b)
Saggar S, Hedley C, and Machay
AD.: Partitioning and translocation of photosynthetically fixed 14C
in grazed hill pastures. Biology and Fertility of Soils 25, 152-158
(1997)
Shimizu, M., Hayashi, M., Matsuya,
K., Murase, J., and Kimura, M.: Comparison of microbial communities
in percolating water from plow layer and subsoil layer estimated by
phospholipid fatty acids (PLFA) analysis. Soil Science and Plant Nutrition
48, 877-881 (2002a)
Shimizu, M., Nakajima, Y.,
Matsuya, K., and Kimura, M.: Comparison of phospholipid fatty acid
composition in percolating water, floodwater, and the plow layer soil
during the rice cultivation period in a Japanese paddy field. Soil Science
and Plant Nutrition 48, 595-600 (2002b)
Swinnen, J., van Veen, J.A.,
Merckx, R.: Rhizosphere carbon fluxes in field-growth spring wheat:
model calculations based on 14C portioning after pulse-labeling. Soil
Biology and Biochemistry 26, 161-170 (1994b)
Tanahashi, T., Murase, J.,
Matsuya, K., Asakawa, S., and Kimura, M.: Microbial communities responsible
for the decomposition of rice straw compost in a Japanese rice paddy
field determined by phospholipid fatty acid (PLFA) analysis. Soil Science
and Plant Nutrition 50, 1229-1236 (2004)
Watanabe, A., Machida, M.,
Takahashi, K., Kitamura, S., and Kimura M.: Flow of photosynthesized
carbon from rice plants into the paddy soil ecosystem at different stages
of rice growth. Plant and Soil 258, 151-160 (2004).
Yamagishi, T., Watanabe, J.,
Okuda, K., Hayashi, T., Kumura, A., Murata, Y.,: Cycling of carbon
in a paddy field. II. Biomass and gross production of algae. Japanese
Journal of Crop Science 49, 146-155. (1980b)
岩田武司・奥田 東:肥料試験におけ二三の予措的調査、日本土壌肥料学雑誌、11, 610-614 (1937)
今関常次郎:稲ノ連作及之レニ基ク土壌成分ノ変化ニ関スル試験、農業試験場報告、42, 81-152 (1917)
佐伯敏郎・山崎史織:水田雑草と光環境、「環境科学」研究報告B18-R12-1、pp.49-53、文部省「環境科学」特別研究「農地生態」研究班
(1978)
山崎史織・佐伯敏郎:水田雑草と光環境、「環境科学」研究報告B35-R12-2、pp.31-34、文部省「環境科学」特別研究「農地生態」研究班
(1979)
山崎史織・佐伯敏郎:水田雑草と光環境、「環境科学」研究報告B61-R12-9、pp.8-17、文部省「環境科学」特別研究「農地生態」研究班
(1980)
倉沢秀夫:水田に於けるPlankton及びZoobenthosの組成並びにStanding Cropの季節変化(1).資源科学研究所彙報、41-42,
86-98 (1956)
木村眞人:水田における有機物の分解と炭素循環、木村眞人・波多野隆介編『土壌圏と地球温暖化』pp.139-165、名古屋大学出版会 (2005)
木村真人、高井康雄:水田における有機物の供給と分解.微生物生態研究会編『微生物の生態12.有機物負荷と環境浄化』pp.41ー60、学会出版センター
(1984)
木村眞人、田中準浩、和田秀徳、高井康雄1980:水田圃場における粗大植物遺体の分解過程(第1報)粗大植物遺体の重量および炭素率の経時的変動.日本土壌肥料学雑誌、51,
169-174
土壌生物化学のページへ